سمّیت آمونیاکی در آبزی پروری
آمونیاک در دوشکل وجود دارد: غیر یونیزه یا NH3 که معمولاً به نام آمونیاک شناخته می شود و یونیزه یا NH4+ که به آن آمونیوم گفته می شود.غلظت هریک از اشکال یاد شده وابسته به pH و دمای آب می باشد. در pH پائین، یون هیدروژن اضافی موجود در محیط( H+)، تعادل را به سمت تولید آمونیوم هدایت می نماید. در pH بالا، کمبود یون هیدرونیوم سبب تولید آمونیاک می شود. دما در این زمینه نقش کمتری دارد با این حال در دماهای بالاتر، آمونیاک غیر یونیزه در هر مقدار pH بالاتر از نوع یونیزه آن است.
این مفهوم
برای آبزی پروران ، اهمیتی بیش از مطالب آکادمیک صرف دارد چرا که تنها شکل غیر
یونیزه آمونیاک برای آبزیان سمّی است. بنابراین، مقادیرآمونیاک تام( مجموع آمونیاک
غیر یونیزه و یونیزه) را می بایست با توجه به pH و دمای محیط تفسیر نمود. عموماً گفته شده
است که مقادیر آمونیاک غیر یونیزه بالاتر از 0.02 پی پی ام، برای آزیان سمّی خواهد
بود. با این حال، این مقدار بر حسب گونه آبزی متغیر است.
این موضوع که کاهش pH موجب کاهش سمّیت آمونیاک می گردد، برای آبزی
پروران نکته مثبتی است.در فرآیند دفع در آبزیان، دی اکسید کربن و آمونیاک دو ترکیب
عمده محسوب می شوند. واکنش دی اکسید کربن با آب، تولید اسید کربنیک می نماید. در
غیاب خاصیت بافری آب، تولید اسیدکربنیک، سبب کاهش pH آب و کم نمودن سمیّت آمونیاکی می شود که
همزمان به عنوان ماده دفعی توسط آبزی به محیط وارد شده است. اما مطمئناً آبزی
پروران نمی توانند چندان به این واکنش شیمیایی خوشبین باشند چرا که کاهش pH به خودی خود سبب تأثیر منفی بر چرخه
نیتریفیکاسیون می گردد.

چرخه نیتریفیکاسیون
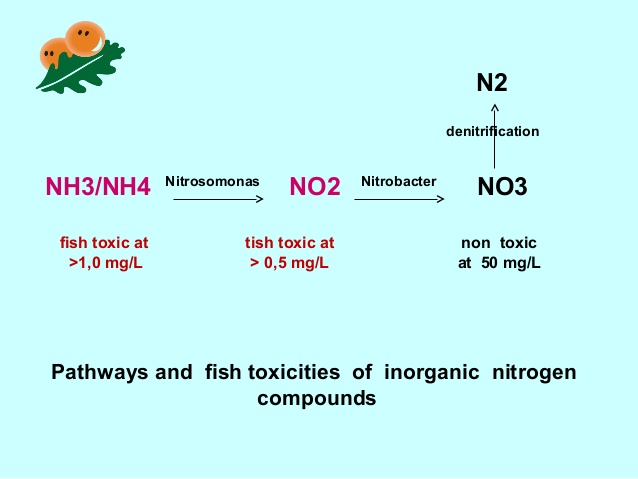
نیتریفیکاسیون، فرآیندی زیستی است که در آن، باکتری ها از ترکیبات نیتروژن دار احیا شده نظیر آمونیاک به عنوان غذا استفاده نموده و آن ها را اکسیده می کنند.
این فرآیند، بخش مهمی از چرخه جهانی نیتروژن در سراسر کیهان محسوب می گردد. بنابراین گستره وسیعی را در بیوسفر به خود اختصاص می دهد. این فرآیند، توسط مهندسین بهداشت محیط در مراکز تصفیه پساب برای حذف آمونیاک از لجن مورد استفاده قرار می گیرد. در قسمتی از این واکنش، که برای آبزی پروری در سیستم مدار بسته واجد اهمیت می باشد، آمونیاک( NH3 یا NH4+) توسط باکتری های شوره گذار، به ترکیبی با درجه احیاء پائین تر (نیتریت یا NO2) تبدیل می گردد که اگرچه همچنان برای آبزیان سمّی است اما سمّیت آن کمتر از آمونیاک است.
غالباً در متون علمی و تحقیقاتی زیست شناسی، نیتروزوموناس ها را به عنوان باکتری های مؤثر در این واکنش معرفی می نمایند.با این حال، در محیط آبزی، شاید سایر باکتری ها از اهمیت بیشتری برخوردار باشند. شاید بهتر باشد این دسته از باکتری ها را باکتری های تبدیل کننده آمونیاک به نیتریت بنامیم.پس از این مرحله نیتریت اکسید و به نترات تبدیل می گردد( که مجدداً به طور معمول باکتری های مسئول در این فرآیند را نیتروباکترها معرفی می شوند و به نظر می رسد باکتری های تبدیل کننده نیتریت به نیترات عبارت مناسب تری باشد).
نیترات برای آبزیان نسبتاً فاقد سمّیت شناخته شده و تجمع آن در مخزن یا استخر پرورش امکان پذیر است تا زمانی که به واسطه تعویض آب و یا تبدیل به شکل گازی (N2) از محیط خارج شود. این تبدیل توسط با کتری های بی هوازی هتروتروف انجام شده و گاز ازت طی فرآیندی به نام ئنیتریفیکاسیون به جو رها می گردد.
از آنجا که نیتریفیکاسیون و تبدیل آمونیاک به گاز ازت، روندی زیستی محسوب می شود، ایجاد جمعیت باکتریایی به میزان مطلوب و کاهش بار سمی ترکیبات نیتروژن دار محیط نیازمند صرف زمان است. در واقع لازم است در ابتدا جمعیت باکتری های اکسید کننده آمونیاک به حد کافی تکثیر شود تا پس از تولید نیتریت در محیط، باکتری های تبدیل کننده نیتریت به نیترات ، ترکیب مورد استفاده خود را در محیط در اختیار داشته باشند
باکتری های مسئول نیتریفیکاسیون در pH پائین تر از 7 رشد خوبی نداشته و اگر pH محیط اسیدی باشد قادر به انجام نیتریفیکاسیون نخواهند بود. این موضوع سبب می شود آبزی پروران به ویژه در سیستم های مدار بسته ناچار به ایجاد تعادل باشند. اگر pH تا محدوده 8 و یا بالاتر ارتقاء یابد حتی کمترین مقادیر آمونیاک که توسط باکتری های مسئول نیتریفیکاسیون به نیتریت تبدیل نشده باشد به سمّیت آمونیاکی منجر می شود و برعکس، اگر pH به زیر 7 تنزّل یابد، این باکتری ها از فعالیت بازمانده و ممکن است شرایط به نحوی هدایت شود که موجب تجمع آمونیاک تا مقادیر سمّی ، حتی در pH نه چندان پائین گردد. مدیران سامانه های مختلف آبزی پروری، معمولاً با استفاده از ترکیبات ایجاد کننده حالت بافری در آب، pH محیط را در محدوده مطلوب بین 7 تا 8 حفظ می کنند.