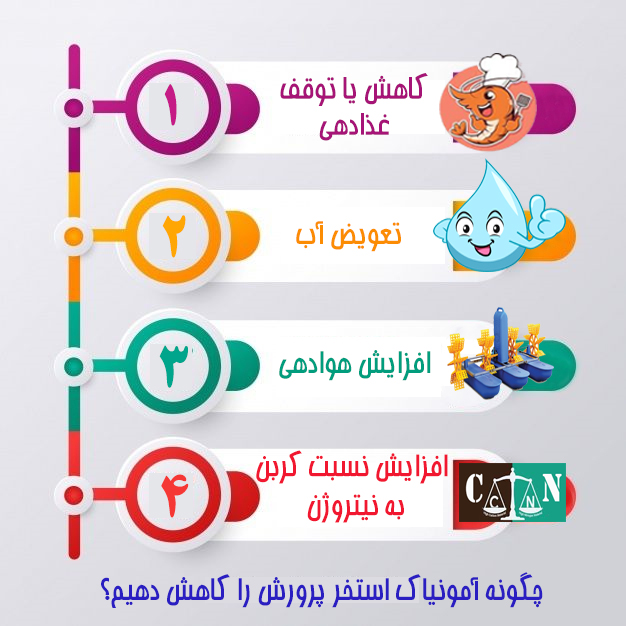
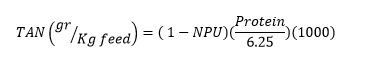غالباً ارتباط دادن مطالب تئوری با عملی، هرگاه با مصادیق همراه نباشد، بسیار مشکل و عمدتاً فرّار خواهد بود. در خصوص ارتباط افزایش تراکم ذخیره سازی با غذادهی و به تبع آن، افزایش آمونیاک( به عنوان متابولیت مضر) تاکنون در متون علمی، کارگاه های آموزشی و ... به کرّات سخن گفته شده است . با این حال از یک سو، اهمیت موضوع و از سوی دیگر قلّت مصادیق و مثال های محاسباتی در خلال این مباحث، شاید ضرورت پرداخته شدن به چنین مطلبی را مؤکّدتر می سازد.
در این زمینه، مطلب حاضر را به ترجمه بخشی از کتاب معروف توماس لاوسون با عنوان "مبانی مهندسی آبزی پروری" اختصاص داده ام و امیدوارم مورد استفاده بازدید کنندگان عزیز واقع گردد :
... میزان آمونیاک مترشحه توسط ماهی از طریق فرمول ارائه شده توسط Boyd و Tucker و با محاسبه پروتئین خالص مصرفی( مقدار پروتئین افزوده شده به بیوماس ماهی به ازاء پروتئین موجود در غذا) قابل تخمین است :
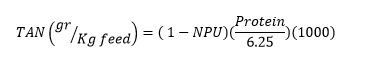
در این فرمول، TAN به عنوان مقدار کل نیتروژن آمونیاکی( با واحد گرم به ازاء هر کیلو گرم غذا) و NPU به عنوان پروتئین خالص مصرفی در نظر گرفته شده است.
در همین ابتدا لازم است (با عنایت به تعریف ارائه شده برای NPU در پاراگراف بالا ) به این نکته توجه شود که هرچه NPU کمتر( و در واقع میزان جذب پروتئین از خوراک مصرفی، نامطلوب تر)، ضریب فرمول افزایش یافته و در نتیجه میزان نیتروژن آمونیاکی( TAN) بالاتر خواهد بود.
در مثالی که در کتاب یاد شده برای محاسبه نیتروژن آمونیاکی تام ( TAN) ارائه گردیده، مقدار پروتئین خوراک، 25 درصد در نظرگرفته شده است که بالطّبع، در خصوص میگو، این مقدار، بالاتر می باشد و این نیز بر مقدار نیتروژن آمونیاکی تولید شده در مزارع پرورش میگو خواهد افزود.
با هم به محاسبه TAN خوراکی با 25 درصد پروتئین و NPU معادل 0.4 ( بر اساس مقدار توصیه شده توسط ویلسون در سال 1976) می پردازیم:

حال اگر با توجه به فرمول فوق،میزان نیتروژن آمونیاکی در غذای میگو با پروتئین 40 درصد و NPU پائین تر( بر اساس هضم پذیری کمتر) در حدود 0.3 در نظر گرفته شود، حاصل فرمول به شکل ذیل خواهد گردید:

به این ترتیب، در زمینه خوراک میگو با هضم پذیری نسبی پائین و پروتئین بالا( در حدود 40 درصد)، تقریباً 1.8 برابر نیتروژن آمونیاکی بیشتر تولید خواهد شد.
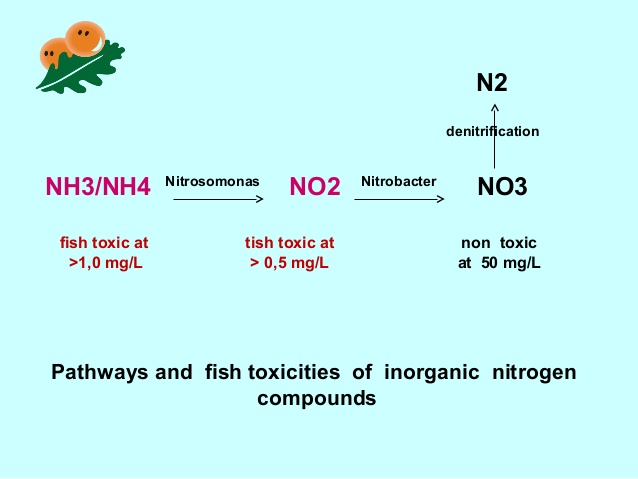
این مثال، نشان دهنده رابطه مستقیم بین آمونیاک وارد شده به استخر با میزان غذادهی است چرا که هرگاه مقدار غذای وارد شده به استخر بیشتر شود، مقدار TAN محیط استخر نیز افزایش می یابد و بدیهی است، یکی از عوامل افزایش مقدار غذادهی، تراکم ذخیره سازی بالاست.